Inhibición in vitro e in vivo de Vibrio spp. aislados del langostino Litopenaeus vannamei utilizando bacterias ácido lácticas nativas
DOI:
https://doi.org/10.25268/bimc.invemar.2023.52.1.1156Palabras clave:
cultivo de camarón, vibriosis, resistencia bacteriana, probiótico, alternativa a antibióticosResumen
Las enfermedades originadas por Vibrio spp. ocasionan las mayores pérdidas económicas en el cultivo de langostino, la terapia antibiótica ha originado el surgimiento de cepas resistentes por lo que se está investigando el uso de probióticos para su tratamiento. Esta investigación tuvo como objetivo obtener bacterias ácido lácticas (BAL) nativas aisladas de langostinos de cultivo y determinar su potencial probiótico contra Vibrio spp. resistentes a antibióticos in vitro e in vivo. Se aislaron nueve cepas tanto de BAL como de Vibrio spp. de langostinos de cultivo de Tumbes. Se determinó la resistencia antibiótica de Vibrio spp.; así como el poder inhibidor in vitro de las cepas de BAL contra dichas cepas, mediante ensayo en pozo de agar e in vivo, mediante infección experimental de langostinos con cepas
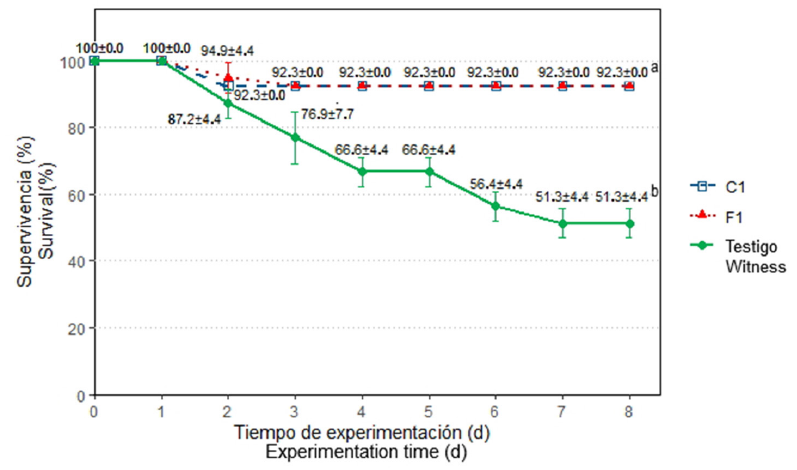
de Vibrio spp. y tratamiento por ocho días con cepas de BAL adicionadas al alimento balanceado. Las nueve cepas de Vibrio spp. aisladas de langostinos de cultivo, fueron resistentes a fosfomicina y ácido nalidíxico, con un índice de resistencia múltiple a antibióticos (MAR) de 0,2. En el ensayo in vitro, las cepas C1L, F1L y F3L, inhibieron el mayor número de cepas de Vibrio spp.; así también, in vivo, las cepas C1L y F1L, incrementaron significativamente (p < 0,05) la supervivencia y disminuyeron en el hepatopáncreas, el recuento de Vibrio spp.
de los langostinos infectados. Se concluye que las cepas de Vibrio spp. resistentes a antibióticos aislados de langostinos de cultivo pudieron ser inhibidas por las cepas de BAL nativas, C1L y F1L, demostrando un prometedor potencial probiótico.
Citas
Aguirre, L.E. 2019. Efecto del neem (Azadirachta indica) y orégano (Origanum vulgare) en el crecimiento de Vibrio spp. resistentes a antibióticos, aislados de Litopenaeus vannamei. Tesis Ing. Pesq., Univ. Nacional de Tumbes, Tumbes. 62 p.
Albuquerque, R., R.L. Araújo, O.V. Souza and R.H.S. Vieira. 2015. Antibiotic-resistant vibrios in farmed shrimp. Biomed. Res. Int., 2015:1–5. https://doi.org/10.1155/2015/505914
Aranguren, L.F., H.N. Mai, B. Noble and A.K. Dhar. 2020. Acute hepatopancreatic necrosis disease (VPAHPND), a chronic disease in shrimp (Penaeus vannamei) population raised in Latin America. J. Invertebr. Pathol., 174:107424. https://doi.org/10.1016/j.jip.2020.107424
Banerjee, S., M.C. Ooi, M. Shariff and H. Khatoon. 2012. Antibiotic resistant Salmonella and Vibrio associated with farmed Litopenaeus vannamei. Sci.World. J., 2012:1–6. https://doi.org/10.1100/2012/130136
Bermúdez-Almada, M.D.C., A. Espinosa-Plascencia, M.L. Santiago-Hernández, C.J. Barajas-Borgo y E. Acedo-Félix. 2014. Comportamiento de oxitetraciclina en camarón de cultivo Litopenaeus vannamei y la sensibilidad a tres antibióticos de bacterias de Vibrio aisladas de los organismos. Biotecnia, 16(3):29. https://biotecnia.unison.mx/index.php/biotecnia/article/view/138
Bleichenbacher, S., M.J.A. Stevens, K. Zurfluh, V. Perreten, A. Endimiani, R. Stephan and M. Nüesch-Inderbinen. 2020. Environmental dissemination of carbapenemase-producing Enterobacteriaceae in rivers in Switzerland. Environ. Pollut., 265: 115081. https://doi.org/10.1016/j.envpol.2020.115081
Cayul, A.A. 2003. Estudio de resistencia a antimicrobianos de uso frecuente en medicina veterinaria, de patógenos bacterianos aislados de metritis bovina en rebaños lecheros de la décima región. Tesis Med. Vet., Universidad Austral de Chile, Valdivia. 95 p.
Chandrakala, N. and S. Priya. 2017. Vibriosis in shrimp aquaculture a review. Int. J. Sci. Eng., 3(2):27–33.
Churqui, J.M. 2020. Bacterias ácido lácticas aisladas con capacidad antagónica de cepas de Escherichia coli y Staphylococcus aureus de quesos frescos expendidos en tres mercados de la ciudad de Puno-2017. Tesis Biol., Universidad Nacional del Altiplano, Puno. 58 p.
CLSI. 2019. Performance standards for antimicrobial susceptibility testing. CLSI Supplement M100. 29th ed. CLSI, Wayne. 282 p.
Culot, A., N. Grosset, Q. Bruey, M. Auzou, J.-C. Giard, B. Favard, A. Wakatsuki, S. Baron, S. Frouel, C. Techer and M. Gautier. 2021. Isolation of Harveyi clade Vibrio spp. collected in aquaculture farms: How can the identification issue be addressed?. J. Microbiol. Meth., 180:106106. https://doi.org/10.1016/j.mimet.2020.106106
de Souza, C. and A.H.L. Wan. 2021. Vibrio and major commercially important vibriosis diseases in decapod crustaceans. J. Invertebr. Pathol., 181: 107527.https://doi.org/10.1016/j.jip.2020.107527
Devi, R., P.K. Surendran and K. Chakraborty. 2009. Antibiotic resistance and plasmid profiling of Vibrio parahaemolyticus isolated from shrimp farms along the southwest coast of India. World J. Microbiol. Biotechnol., 25(11):2005–2012. https://doi.org/10.1007/s11274-009-0101-8
Dutta, D., A. Kaushik, D. Kumar and S. Bag. 2021. Foodborne pathogenic vibrios: Antimicrobial resistance. Front. Microbiol., 12: 638331. https://doi.org/10.3389/fmicb.2021.638331
Esguerra, D.A. 2012. Evaluación en un sistema cerrado de cuatro aislados bacterianos con potencial probiótico en la dieta de tilapia Oreochromis niloticus. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Santa Marta. 48 p.
FAO. 2020. The state of world fisheries and aquaculture 2020. FAO, Rome. 224 p.
Gómez-Gil, B., A. Roque y S. Soto-Rodríguez. 2015. Vibriosis en camarones y su diagnóstico: 137–150. En: Ruiz-Luna, A., C.A. Berlanga-Robles y M. Betancourt (Eds.). Avances en acuicultura y manejo ambiental. Trillas: CIAD, Hermosillo. 150 p.
Huynh, T.-G., C.-C. Chi, T.-P. Nguyen, T.-T.-T.H. Tran, A.-C. Cheng and C.-H. Liu. 2018. Effects of synbiotic containing Lactobacillus plantarum 7-40 and galactooligosaccharide on the growth performance of white shrimp, Litopenaeus vannamei. Aquac. Res., 49(7):2416–2428. https://doi.org/10.1111/are.13701
Huynh, T.-G., S.-Y. Hu,, C.-S. Chiu, Q.-P. Truong and C.-H. Liu. 2019. Bacterial population in intestines of white shrimp, Litopenaeus vannamei fed a synbiotic containing Lactobacillus plantarum and galactooligosaccharide. Aquac. Res., 50(3):807–817. https://doi.org/10.1111/are.13951
Jeyasanta, K.I., T. Lilly and J. Patterson. 2017. Prevalence of Vibrio species in the cultured shrimp and their antibiotic resistants. Asian J. Appl. Sci., 1(8):100–111.
Karthik, R., A.J. Hussain and R. Muthezhilan. 2014. Effectiveness of Lactobacillus sp (AMET1506) as probiotic against vibriosis in Penaeus monodon and Litopenaeus vannamei shrimp aquaculture. Biosci. Biotechnol. Res. Asia, 11(SE):297–305. https://doi.org/10.13005/bbra/1423
Kewcharoen, W. and P. Srisapoome. 2019. Probiotic effects of Bacillus spp. from Pacific white shrimp (Litopenaeus vannamei) on water quality and shrimp growth, immune responses, and resistance to Vibrio parahaemolyticus (AHPND strains). Fish Shellfish Immunol., 94: 175–189. https://doi.org/10.1016/j.fsi.2019.09.013
Khelissa, S., N.-E. Chihib and A. Gharsallaoui. 2020. Conditions of nisin production by Lactococcus lactis subsp. lactis and its main uses as a food preservative. Arch. Microbiol., 203(2):465-480. https://doi.org/10.1007/s00203-020-02054-z Marine and Coastal Research Institute 25
Krishnani, K.K., V. Kathiravan, N.A. Shakil, M.K. Singh, M.P. Brahmane, K.K. Meena, B. Sarkar, K. Choudhary, M.K. Singh and J. Kumar. 2015. Bactericidal activity of nanopolymers against shrimp pathogenic bacterium Vibrio harveyi. Proc. Natl. Acad. Sci. India Sect. B Biol. Sci., 85(4):1079–1086. https://doi.org/10.1007/s40011-015-0517-x
Kumaran, M., P.R. Anand, J.A. Kumar, T. Ravisankar, J. Paul, K.P.K. Vasagam, D.D. Vimala and K.A. Raja. 2017. Is Pacific white shrimp (Penaeus vannamei) farming in India is technically efficient? — A comprehensive study. Aquaculture, 468: 262–270. https://doi.org/10.1016/j.aquaculture.2016.10.019
Kurdi, M.M., S. Mutalib, M. Ghani, N.A.M. Zaini and A.A. Ariffin. 2019. Multiple antibiotic resistance (MAR), plasmid profiles, and DNA polymorphisms among Vibrio vulnificus isolates. Antibiotics, 8(2):68. https://doi.org/10.3390/antibiotics8020068
Lamari, F., K. Sadok, A. Bakhrouf and F.-J. Gatesoupe.2014. Selection of lactic acid bacteria as candidate probiotics and in vivo test on Artemia nauplii. Aquac. Int., 22(2):699–709. https://doi.org/10.1007/s10499-013-9699-5
Le, B. and S.H. Yang. 2018. Probiotic potential of novel Lactobacillus strains isolated from salted-fermented shrimp as antagonists for Vibrio parahaemolyticus. J. Microbiol., 56(2):138–144
Letchumanan, V., N.-S. Ab Mutalib, S.H. Wong, K.-G. Chan and L.-H. Lee. 2019. Determination of antibiotic resistance patterns of Vibrio parahaemolyticus from shrimp and shellfish in Selangor, Malaysia. Prog. Microbes Mol. Biol., 2(1):a0000019.
Luis-Villaseñor, I.E., D. Voltolina, B. Gomez-Gil, F. Ascencio, Á.I. Campa-Córdova, J.M. Audelo-Naranjo and O.O. Zamudio-Armenta. 2015. Probiotic modulation of the gut bacterial community of juvenile Litopenaeus vannamei challenged with Vibrio parahaemolyticus CAIM 170. Lat. Am. J. Aquat. Res., 43(4):766–775. https://doi.org/10.3856/vol43-issue4-fulltext-15
Mahjoub, M., M. Mirbakhsh, M. Afsharnasab, S. Kakoolaki and S. Hosseinzadeh. 2019. Inhibitory activity of native probiotic Bacillus vallismortis IS03 against pathogenic Vibrio harveyi under in vitro and in vivo conditions in Litopenaeus vannamei. Iran. J. Aquat. Anim. Health, 5(2): 54–66. https://doi. org/10.29252/ijaah.5.2.54
Mulyadi, N.I. and W. Iba. 2020. Efficacy of seaweed (Sargassum sp.) extract to prevent vibriosis in white shrimp (Litopenaeus vannamei) juvenile. Int. J. Zool. Res., 16(1):1–11. https://doi.org/10.3923/ijzr.2020.1.11
NCCLS. 1999. Methods for dilution antimicrobial susceptibility test for bacteria that grow aerobically. Approved Standard. NCCLS Document M7-A3. 3rd Edition. NCCLS, Wayne. 282 p.
Pandiyan, P., D. Balaraman, R. Thirunavukkarasu, E.G.J. George, K. Subaramaniyan, S. Manikkam and B. Sadayappan. 2013. Probiotics in aquaculture. Drug Invent. Today, 5(1):55–59. https://doi.org/10.1016/j.dit.2013.03.003
Quispe, G.W., M.B. Mantilla, A. Cama., Y. Ortega y N. Sandoval. 2020. Aislamiento de bacterias nativas de Oncorhynchus mykiss con potencial probiótico frente a Yersinia ruckeri. Rev. Investig. Vet. Perú, 31(4):e19024. http://dx.doi.org/10.15381/rivep.v31i4.19024
Rebouças, R.H., O.V. de Sousa, A. Sousa, F.R. Vasconcelos, P. Barroso and R.H. Silva. 2011. Antimicrobial resistance profile of Vibrio species isolated from marine shrimp farming environments (Litopenaeus vannamei) at Ceará, Brazil. Environ. Res., 111(1):21–24. https://doi.org/10.1016/j.envres.2010.09.012
Rodríguez, A. 2017. Probióticos en la producción piscícola. Tesis Biotec. Agr., Univ. Nal. Abierta Distancia, Neiva, Colombia. 35 p.
Rosado, A.A. 2018. Resistencia antimicrobiana de bacterias del género Vibrio en langostino blanco (Litopenaeus vannamei) en centros de cultivo de la región Tumbes. Tesis Med. Vet., Univ. Ricardo Palma, Lima. 91 p.
RSPCA. 2016. Humane killing and processing of crustaceans for human consumption. RSPCA Australia, Victoria. 9 p.
Saavedra-Olivos, K.Y., T. Peralta-Ortiz, A. Ordinola-Zapata, J.E. Sandoval-Ramayoni, E.G. Vieyra-Peña, M.A. Zapata-Cruz, A. Hidalgo-Mogollón, B. Morán, O. A. Mendoza-Neyra, M.E. Mendoza-Dioses y S.Y. Campoverde-Peña. 2018. Detección de una proteína asociada a la enfermedad de la necrosis hepatopancreática aguda (AHPND) en Litopenaeus vannamei bajo cultivo semi-intensivo en Ecuador. Rev. Investig. Vet. Perú, 29(1):328. https://doi.org/10.15381/rivep.v29i1.14194
Sabir, M., M.M. Ennaji y N. Cohen. 2013. Vibrio alginolyticus: An emerging pathogen of foodborne diseases. Int. J. Sci. Technol., 2(4):302–309.
Tan, C.W., Y. Rukayadi, H. Hasan T.Y. Thung, E. Lee, W.D. Rollon, H. Hara, A.Y. Kayal, M. Nishibuchi and S. Radu. 2020. Prevalence and antibiotic resistance patterns of Vibrio parahaemolyticus isolated from different types of seafood in Selangor, Malaysia. Saudi J. Biol. Sci., S1319562X20300036. https://doi.org/10.1016/j.sjbs.2020.01.002
Uppal, B., B. Mehra, P.S. Panda and S.K. Kumar. 2017. Antimicrobial susceptibility profile of Vibrio cholerae strains isolated at a tertiary care medical centre in New Delhi, India. Int. J. Com. Med. Publ. Health, 4(3):868. https://doi.org/10.18203/2394-6040.ijcmph20170775
Varela-Mejías, A. y R. Alfaro-Mora. 2018. Revisión sobre aspectos farmacológicos a considerar para el uso de antibióticos en la camaronicultura. Rev. Investig. Vet. Perú, 29(1):1–14. https://doi.org/10.15381/rivep.v29i1.14186
Vieco-Saiz, N., Y. Belguesmia, R. Raspoet, E. Auclair, F. Gancel, I. Kempf and D. Drider. 2019. Benefits and inputs from lactic acid bacteria and their bacteriocins as alternatives to antibiotic growth promoters during food-animal production. Front. Microbiol., 10:57. https://doi.org/10.3389/fmicb.2019.00057
Watts, J., H. Schreier, L. Lanska and M. Hale. 2017. The rising tide of antimicrobial resistance in aquaculture: sources, sinks and solutions. Mar. Drugs, 15(6):158. https://doi.org/10.3390/md15060158
Zhao, Y., X. Zhang, Z. Zhao, C. Duan, H. Chen, M. Wang, H. Ren, Y. Yin and L. Ye. 2018. Metagenomic analysis revealed the prevalence of antibiotic resistance genes in the gut and living environment of freshwater shrimp. J. Hazard Mater., 350: 10–18. https://doi.org/10.1016/j.jhazmat.2018.02.004
Zhao, Y., Q.E. Yang, X. Zhou, F.-H. Wang, J. Muurinen, M.P. Virta, K.K. Brandt and Y.-G. Zhu. 2020. Antibiotic resistome in the livestock and aquaculture industries: Status and solutions. Crit. Rev. Environ. Sci. Technol., 2020: 1–38. https://doi.org/10.1080/10643389.2020.1777815
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2023 Vicsy Yanet Tinoco Elizalde, Tessy Peralta-Ortiz, Alberto Ordinola-Zapata

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.

